Estados de Saturación y Lectura de Tablas Termodinámicas.
Hola a todos, en esta entrada repasaremos el análisis de los estados de saturación de un sistema y su relación para la determinación de propiedades termodinámicas mediante la lectura de tablas de vapor. Comenzaremos con algunas definiciones básicas:
Estados de saturación.
Responderemos la pregunta:
¿Cuál es la diferencia entre líquido comprimido, líquido saturado, vapor saturado y vapor sobrecalentado?
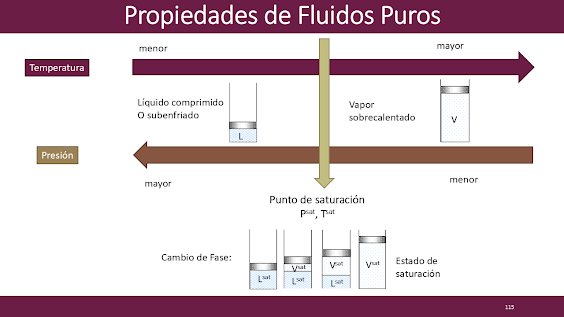
Una sustancia pura es aquella que presenta una composición química fija. Dependiendo de sus condiciones de temperatura y presión, un fluido se puede encontrar en uno de los siguientes estados:
Líquido comprimido (también llamado subenfriado):
Es aquel que no está a punto de vaporizarse.
El sistema se encuentra a temperatura que está debajo de la temperatura de saturación pero encima de la presión de saturación de la sustancia.
Líquido saturado:
Es aquel líquido que está a punto de vaporizarse.
Es sistema se encuentra a las condiciones de saturación (a la temperatura de evaporación que presenta la sustancia a la presión que presenta).
Vapor Saturado:
Es aquel vapor que está a punto de vaporizarse.
Es sistema se encuentra a las condiciones de saturación (a la temperatura de evaporación que presenta la sustancia a la presión que presenta).
Vapor sobrecalentado:
Mezcla de líquido-vapor saturado:
Es aquella mezcla en donde coexiste tanto la fase líquida como la gaseosa. Son estados que se encuentran en medio de los estados de líquido saturado y vapor saturado para una temperatura y presión de saturación de una sustancia pura.
A la fracción masa del vapor en esta mezcla, se le llama calidad. Una mezcla saturada líquido vapor se analiza de la siguiente forma:
Relación con el diagrama de fases.
Tablas de Vapor de agua.
¿Para qué nos sirven estos conceptos en el área de ingeniería?
El conocer el estado en el cual se encuentra una sustancia nos permite determinar sus propiedades termodinámicas mediante tablas (energía interna, entalpía, entropía, energía libre de Gibbs), para poder predecir las variables de un proceso industrial (presión, temperatura y volumen).
Esto se realiza mediante el modelado matemático del proceso, aplicando balances de masa, balances de energía, cinética de las reacciones y las leyes de la termodinámica para predecir las variables de un sistema sometido a un fenómeno físico.




Comentarios
Publicar un comentario